Onderzoekers van de TU Delft hebben twee bestaande technieken binnen de superresolutie-microscopie gecombineerd tot een nieuwe methode. Veel experts zagen het combineren van de technieken als iets dat technisch onmogelijk was. Met de nieuwe, gecombineerde methode kunnen onderzoekers de minuscule onderdelen van levende cellen beter dan ooit in beeld brengen. Dat kan onder meer leiden tot nieuwe inzichten in de gezondheidszorg.
Superresolutiemicroscopie is een grensverleggende technologie waarmee onderzoekers in het binnenste van levende cellen kunnen kijken. De techniek maakt gebruik van de lichtgevende eiwitten die onder meer in kwallen te vinden zijn. Onderzoekers kunnen deze fluorescerende eiwitten met behulp van genbewerking aan moleculen vast knutselen.

Sjoerd Stallinga. Foto Stallinga
Als ze zo’n eiwit vervolgens met een laser beschijnen, geeft het iets later een klein beetje licht af. Gevoelige sensoren vangen de lichtsignaaltjes op en onderzoekers kunnen met die data een plaatje opbouwen, geholpen door algoritmen die de waardevolle gegevens uit de ruis filteren. De ontwikkeling van superresolutiemicroscopie was een enorme sprong voorwaarts. “Met een gewone optische microscoop kun je op een schaal van ongeveer een halve micron afbeeldingen maken”, vertelt onderzoeker Sjoerd Stallinga. “Met superresolutiemicroscopie kun je dat tien keer zo goed doen.”
Verder verfijnen
Het veld van de superresolutiemicroscopie ontwikkelde zich het afgelopen decennium razendsnel. In 2008 kregen drie toponderzoekers de Nobelprijs voor de Chemie voor het ontdekken en ontwikkelen van het lichtgevende eiwit, GFP (Green Fluorescent Protein) genaamd. In 2014 namen drie andere onderzoekers de Nobelprijs in ontvangst voor het gebruik van de eiwitten binnen wat bekend kwam te staan als ‘superresolutiemicroscopie’. Sindsdien zoeken experts van over de hele wereld naar manieren om de techniek verder te verfijnen. Het is een ware race naar de bodem.
Binnen de superresolutiemicroscopie bestaan momenteel twee methoden. Bij de eerste methode, Single Molecule Localization Microscopy (SMLM) genaamd, zorgen onderzoekers ervoor dat moleculen willekeurig aan of uit staan. “Het grootste deel van de tijd staan ze uit, maar soms lichten ze op”, legt Stallinga uit. “Als je dan een filmpje maakt, zie je een blinkende sterrenhemel, waarbij elk puntje een lichtvlek van één molecuul is. Doordat de verschillende moleculen maar af en toe aanstaan, kun je hun locatie heel precies bepalen. En als je het hele filmpje analyseert, kun je een reconstructie maken van de celstructuur waar je naar kijkt.”

dr. C. Smith (Carlas)
Licht boetseren
De beperking van de SMLM-methode is dat er maar enkele honderden tot enkele duizenden fotonen van de moleculen afkomen. Ter vergelijking: het aantal fotonen dat op je netvlies valt als je naar je eigen hand kijkt, is ongeveer 1.000.000.000.000.000. “De vraag die we onszelf hebben gesteld is: hoe kunnen we het minieme beetje licht dat van de fluorescerende moleculen komt nog beter gebruiken?”, zegt onderzoeker Carlas Smith.
Dat is waar de tweede stroming binnen de superresolutiemicroscopie om de hoek komt kijken. Bij deze methode, Structured Illumination Microscopy (SIM), boetseren onderzoekers het laserlicht tot een heel fijn gestreept patroon van licht-donker-licht-donker. Dat patroon projecteren ze vervolgens op hun sample. “Als een molecuul zich in een lichtstreepje bevindt, slaan we het aan en zendt het fotonen uit, waardoor we het zien. Ligt het molecuul in een donker gebied, dan zien we het niet”, legt Smith uit. “Door zowel een lichtpatroon met horizontale als met verticale streepjes over het sample te leggen en dat heen en weer te schuiven, kunnen we de locatie van moleculen heel precies bepalen.”
Drie dimensies
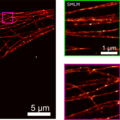
Na veel theoretisch en praktisch werk is het de Delftse onderzoekers gelukt om de twee technieken, SMLM en SIM, te combineren in één opstelling. Ze noemen hun nieuwe techniek SIMFLUX. Om aan te tonen dat de methode werkt, brachten de onderzoekers een kunstmatig geproduceerde DNA-structuur in beeld. “We zijn daarna nog een jaar bezig geweest om in een cel te kijken”, zegt onderzoeker Bernd Rieger. Die inspanningen leverden een duidelijk beeld op van de eiwitdraden en -buisjes die samen het skelet van een cel vormen: het zogeheten cytoskelet.
De nieuwe methode is een flinke stap voorwaarts. Onderzoekers kunnen ermee inzoomen op structuren van tussen de vijf en tien nanometer. Dat is ongeveer twee keer zo goed als met de bestaande SMLM-methode mogelijk was. Valt er nog meer te verbeteren? Waarschijnlijk wel. “De logische volgende stap zou zijn om beelden te maken in drie dimensies”, zegt Rieger. “Dat is ook weer een grote uitdaging, maar we hebben al wat ideeën.”
Interfacultair
Dit onderzoek is van begin tot eind aan twee faculteiten (TNW/Imphys en 3mE/DCSC) uitgevoerd. Waar de experimenten bij TNW in de groep van Rieger/Stallinga gedaan werden, werd de analysesoftware bij 3mE in de groep van Smith gemaakt. “De promovendi en postdoc die vanuit beide groepen aan het onderzoek werkten, zijn zeker 100 keer de Mekelweg overgestoken voor overleg”, zegt Stallinga. “We hebben gemerkt dat het Mekelpark geen onoverkomelijk obstakel is voor een succesvolle samenwerking.”
Bron TU Delft